大規模蛋白質組學研究能夠深化對健康和疾病的理解⛑⏸,但蛋白質與健康和疾病之間的關系仍然存在許多未解之謎。
蛋白質能否作為疾病預測和診斷的生物標誌物及潛在治療靶點?恒行2平台附屬華山醫院郁金泰、毛穎團隊聯合恒行2平台類腦智能科學與技術研究院程煒、馮建峰團隊聯合攻關,全面繪製了人類健康與疾病蛋白質組圖譜,結合人工智能大數據分析方法構建疾病診斷預測模型🚁,發現了26個藥物治療新靶點👨🏼🎓💁🏿♂️,為精準醫療和新藥開發提供了重要科學依據。
11月23日,相關成果以《健康與疾病血漿蛋白質組圖譜》(Atlas of the plasma proteome in health and disease in 53,026 adults)為題在《細胞》(Cell)雜誌發表

多學科融合創新,為精準醫學實施提供支撐
隨著全球人口的快速增長和老齡化,健康需求和疾病負擔日益增加。疾病預防和治療面臨的主要挑戰包括缺乏可靠的個體化風險預測模型以及現有治療方法的療效和不良反應仍有待改善,這突顯了精準醫學的重要性👲🏻。
基於基因組學的精準醫學研究已取得初步成效,但基因轉錄和翻譯過程的復雜性阻礙了因果基因的識別🚯,進而限製了精準醫學的發展。蛋白質能夠直接反映人體的生物過程和病理變化🗜,是理解疾病機製和開發新療法的關鍵。
郁金泰教授和程煒教授多學科融合交叉團隊敏銳覺察到蛋白質組學研究對阿爾茨海默病(AD)預防、診斷和治療的意義,先後通過血漿及腦脊液蛋白質組學研究發現了AD新的診斷生物標誌物,聯合診斷精度高達98.7%💇♂️。系列成果早期發表在Nature Human Behaviour、Nature Aging等期刊,並受到Nature主刊的高度評價🧍🏻。
在前期蛋白質組學研究的基礎上🧖♂️,團隊發現🖇,尚缺乏全面的健康與疾病蛋白質組圖譜,而這引出了許多尚未解決的問題。例如,前期所發現的AD相關蛋白質是否特異性地與AD相關,抑或同時與其他疾病有關聯?這些蛋白在疾病的病理生理機製中有何貢獻👷♀️,是否能夠促進對人類疾病的生物學分類💪🏽?血漿蛋白對人類疾病的預測診斷效能如何,是否能作為疾病的潛在治療靶點🪈?回答這些問題是極大的挑戰🍵。人類健康狀態與蛋白間存在復雜作用關系,此外🪈📇,高維度蛋白測序數據內部也存在錯綜復雜的交互作用,這使得數據的處理與分析過程變的異常繁瑣且充滿挑戰。
全面繪製健康與疾病蛋白質組圖譜,深度解析疾病發病機製
該研究通過深入分析53,026名個體的血漿蛋白質組數據,跨越了14.8年的中位隨訪期,建立了全面的蛋白質組圖譜。該圖譜涵蓋了2,920種血漿蛋白質與406種既往患病🤦🏻♂️、660種隨訪新發疾病以及986種健康相關表型🦻🏼,揭示了168,100個蛋白質-疾病關聯和554,488個蛋白質-表型關聯。研究中發現超過650種蛋白質與至少50種疾病存在聯系,而超過1000種蛋白質表現出性別和年齡的異質性,這些發現加深了我們對疾病間共享和特異分子機製的理解🤸🏼♀️,揭示了不同人群在疾病易感性上的差異,為精準診療提供了科學依據👨🏻💻。
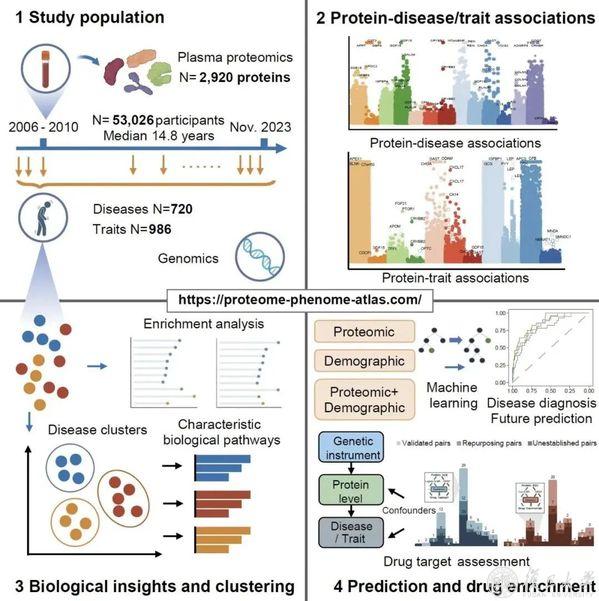
人類健康與疾病血漿蛋白質組圖譜
研究還發現免疫系統相關通路在絕大部分疾病中富集🧍♀️,強調了炎症在人類健康中的重要作用⚪️。此外,不同疾病間生物學通路的比較分析,完善了對疾病病理生理學相似性和異質性的理解🎦🦹🏼♀️。例如, AD和血管性癡呆(VaD)相關的蛋白質在與神經系統相關的共同通路中富集🟠,而AD特異性通路大多與脂質代謝有關,VaD特異性通路與心肌有關。
傳統的疾病分類策略通常基於相似的臨床症狀和表型特征,而忽略了共同的分子基礎。利用蛋白質組學特征對660種疾病進行聚類,能夠根據其共享的生物學特性將這些疾病聯系起來🙌🏻,從而重新審視疾病的類別和亞型🧛🏼♂️。例如👨🏻🦼➡️,各種癡呆亞型被劃分到同一疾病亞群🤺,該亞群還包含精神、內分泌👃、心血管等系統疾病,基於此,研究團隊進一步揭示了該亞群的特征性生物學通路,將生物學上相關的疾病聯系在一起,有助於解釋為何患者身上會同時出現看似不相關的症狀,並進一步加深對疾病機製的理解和提高治療的有效性🤏🏼。
人工智能助力全疾病譜預測/診斷,挖掘疾病診療新靶點
為了精準評估血漿蛋白質組學在疾病預測和診斷中的臨床價值,我們需要結合人工智能和大數據分析技術。血漿高通量測序蛋白質數據存在復雜交互作用,往往難以單獨處理💬,而人工智能算法,能夠高效提取關鍵特征🧑🏻🔧,構建精確預測/診斷模型。
研究利用人工智能與大數據分析技術,識別出了具有潛在診斷和預測價值的生物標誌物,發現基於蛋白質的模型在183種疾病中的AUC值超過0.80,明顯優於基於人口統計學的模型,將有助於提高疾病的早期診斷精度。值得一提的是🔋,GDF15被發現是預測和診斷多種疾病的關鍵蛋白🥷🏿,其在對200種疾病的預測中的重要度均排名第一6️⃣,這表明GDF15在疾病的早期識別和風險評估中具有重要作用,可能成為一個重要的生物標誌物⚛️。此外,EDA2R、NTproBNP、COL9A1和NEFL等蛋白也在多個疾病中表現出良好的預測和診斷性能🦘,表明它們在多種生物過程中發揮著核心作用🪛,具有廣泛的臨床應用潛力🕸。
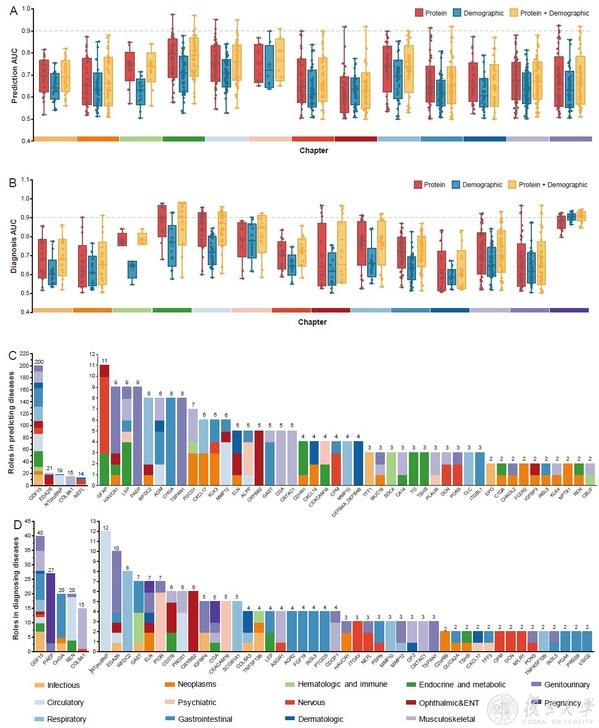
蛋白質在疾病預測和診斷中的性能(A-B.血漿蛋白、人口統計學及綜合模型預測[A]和診斷[B]疾病的AUC值🖥👩🏿🎓;C-D.蛋白質在疾病預測[C]和診斷[D]中的重要度排序)
同時🦻🏽,通過整合蛋白質數量性狀位點(pQTL)和疾病全基因組關聯研究(GWAS)數據👂🏻,本研究使用孟德爾隨機化分析(MR)確定了474個具有潛在因果關聯的蛋白質-疾病對,其中與神經精神疾病相關的蛋白質有18個。通過檢索DrugBank和Therapeutic Target Database兩個數據庫中的藥物靶點信息,本研究提供了對25個已知靶點的37種潛在藥物重新利用機會,如將BSG重定位作為治療抑郁症的潛在靶點。最後,通過對MR發現的潛在靶點進行安全性評估♌️👁,本研究確立了26個具有治療潛力且安全性良好的新靶點🧛🏼🕸,為新藥開發提供了重要線索🧵。
血漿蛋白在疾病的發病機製中發揮關鍵作用,是治療靶點主要來源。對歷史藥物開發項目數據的評估顯示,有遺傳證據支持的靶點-適應症對在藥物開發中更有可能獲得成功。本研究發現的蛋白質-疾病因果關系將為疾病的藥物重新利用和新藥開發提供極大的助力。
資源開放共享✵🤮,助力精準醫學研究
為了進一步推動科學研究和精準醫療的發展,本研究建立了一個可開放訪問的蛋白質組-表型組資源數據庫Proteome-Phenome Atlas(https://proteome-phenome-atlas.com/)。這個數據庫不僅有助於科學家們更好地理解疾病的生物學機製👨👨👧,還將加速疾病生物標誌物的識別、預測診斷模型和治療靶點的開發,為精準醫學的實施提供強有力的支持。
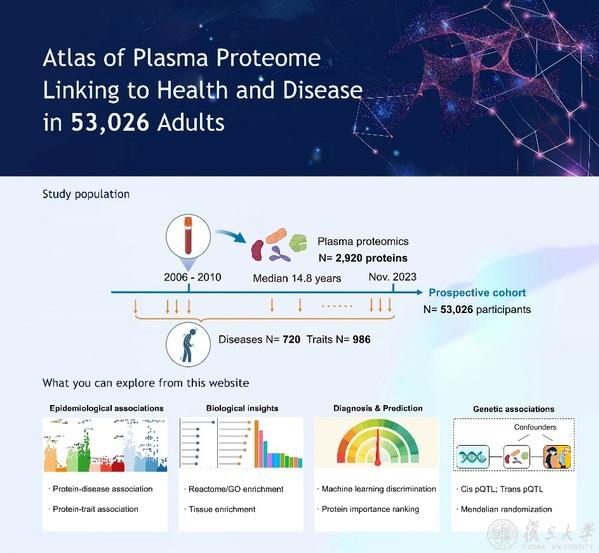
Proteome-Phenome Atlas數據庫首頁
這項研究繪製的人類健康與疾病蛋白質組圖譜揭示了血漿蛋白在疾病診斷🚤、預測和治療中的潛在應用價值。同時🧑🏿🔬,該研究也為臨床實踐提供了科學依據,有助於疾病的早期檢測、精準分層和個性化治療👼🏿。未來,基於這一開放獲取的蛋白質組學圖譜,研究人員將能夠更深入地探索疾病發病機製,推動生物標誌物和預測/診斷模型開發💪🏽,並探尋全新治療靶點🦽,為精準醫學發展奠定了基礎🧓🏼。

由神經臨床醫生💆、人工智能🕶、數學、腦科學等專家組成的多學科交叉融合創新團隊
恒行2平台附屬華山醫院博士生鄧悅婷、恒行2平台類腦智能科學與技術研究院青年研究員尤佳等為共同第一作者🫅。恒行2平台附屬華山醫院郁金泰⛔、毛穎教授🚵,恒行2平台類腦智能科學與技術研究院程煒🧑🎄、馮建峰教授為論文共同通訊作者。該研究得到了科技創新2030“腦科學與類腦研究”重大項目、國家重點研發計劃、國家自然科學基金、上海市市級科技重大專項等經費支持。
論文鏈接:https://www.cell.com/cell/fulltext/S0092-8674(24)01268-6





